Xp11易位性肾细胞癌是以X染色体短臂同其他染色体易位并产生TFE3基因融合为特征的肾细胞癌,常见于儿童和年轻人,其发病率约占儿童肾细胞癌的40%,约占成年人肾细胞癌的1.6%~4.0%。TFE3基因最常见的融合伴侣为ASPL,且ASPL-TFE3易位型肾癌的临床预后比其他类型的Xp11易位性肾癌差。然而,ASPL-TFE3融合蛋白在Xp11易位性肾癌中的功能和具体调控机制尚不清楚。因此,确定TFE3下游通路对进一步理解Xp11易位性肾癌有着重大的意义。必赢76net线路附属金陵医院(东部战区总医院)病理科饶秋教授团队致力于研究Xp11易位性肾细胞癌,多次在该领域发表原创性科研成果。
目前,关于ASPL-TFE3易位性肾癌的基础性研究甚少,ASPL-TFE3融合蛋白的具体功能和作用机制亦尚不清楚。鉴于此,饶秋教授团队通过ChIP-seq与RNA-seq共分析,深入研究了ASPL-TFE3融合基因的转录调控回路,首次发现ASPL-TFE3融合蛋白可直接结合自噬相关基因的启动子区域,强力激活自噬通路。明确了自噬通路在ASPL-TFE3易位性肾癌中的重要作用。考虑到自噬与营养物质代谢之间的联系,研究团队进一步进行了非靶向代谢组学检测。发现ASPL-TFE3融合基因通过激活自噬通路,促进脂质及氨基酸等营养物质的利用,缓解肿瘤细胞的能量应激状态,从而促进肾癌细胞的增殖。最后研究团队发现:在生理情况下,TFE3蛋白受mTOR通路调控入核,而在ASPL-TFE3易位性肾癌的情况下,ASPL-TFE3融合基因反向强力激活mTOR通路,mTOR与自噬通路的异常激活共同促进了肿瘤细胞的增殖(如图)。
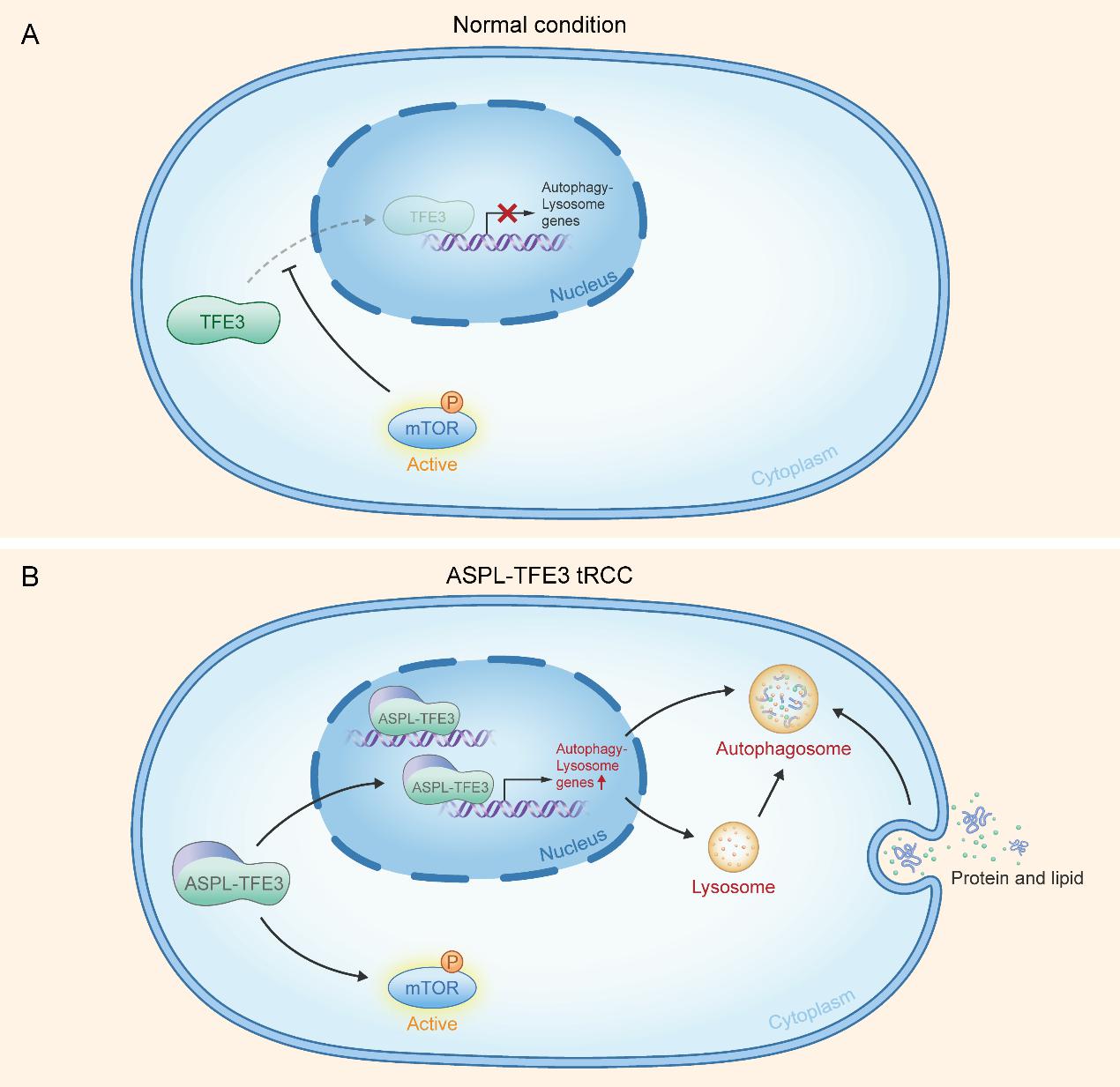
图:工作模式图
本项研究创新点
1.联合RNA-seq,ChIP-seq及代谢组学共分析手段,探寻ASPL-TFE3融合基因的下游调控通路,首次阐明了ASPL-TFE3通过激活自噬驱动肾癌营养物质代谢。
2.与正常情况下“mTOR通路调控TFE3蛋白入核”这一理念不同,ASPL-TFE3融合基因反向激活mTOR通路,提示mTOR与自噬抑制剂联用对ASPL-TFE3易位性肾癌的治疗前景。
3.突破了传统观念中关注单通路调控的固定思维,完整地呈现了ASPL-TFE3融合基因转录调控自噬并反向激活mTOR信号通路,为ASPL-TFE3易位性肾癌的治疗提供了新的思路。
该研究成果近日在医学一区期刊Oncogene(实时IF:9.308)在线发表,文章题目为“Nuclear translocation of ASPL-TFE3 fusion protein creates favorable metabolism by mediating autophagy in translocation renal cell carcinoma”。该论文联合转录组学、表观组学及代谢组学,阐述了ASPL-TFE3易位性肾癌恶性增殖的相关调控回路,打破了易位性肾癌关注单通路调控的固定思维,首次提出ASPL-TFE3融合基因转录调控自噬并反向激活mTOR信号通路,为ASPL-TFE3易位性肾癌的治疗提供了新的思路。在本项目的进程中,研究团队克服了很多困难,饶秋教授提供了研究的设计思路,大力推进实验进展,为论文的通讯作者。同时特别感谢国家自然科学基金的资助。

